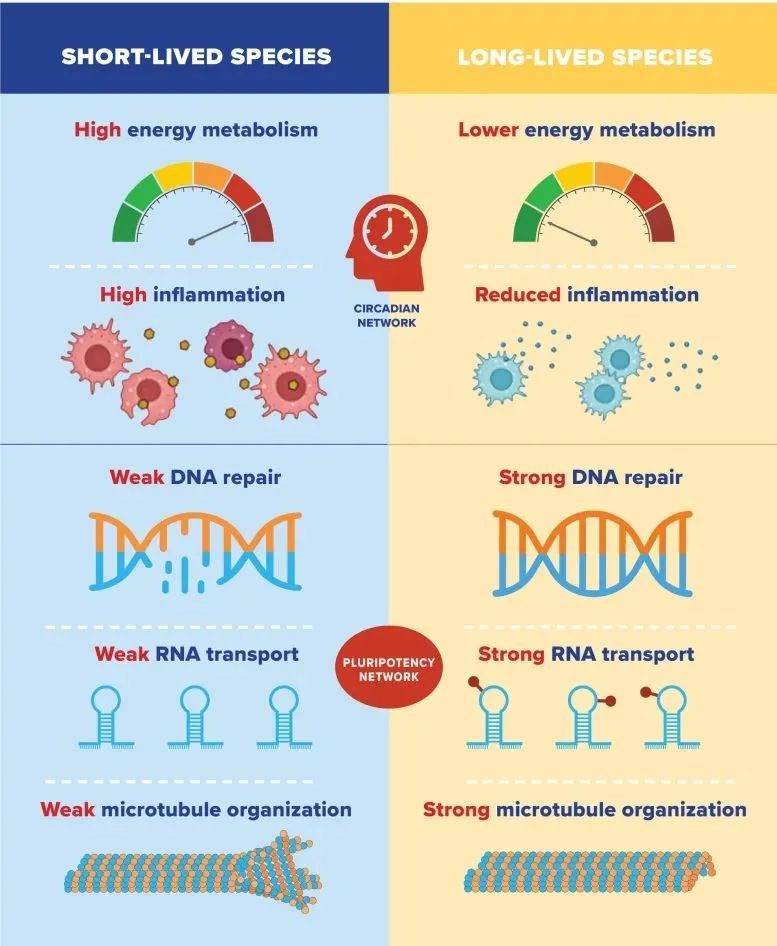
研究人员发现,长寿的生物体通常表现出与DNA修复、RNA运输和细胞骨架组织相关的基因高表达,而与炎症和能量消耗相关的基因低表达。
罗切斯特大学对长寿遗传学感兴趣的研究人员提出了对抗衰老和与年龄有关的疾病的新目标。
通过自然选择,产生了衰老速度差异巨大的哺乳动物。例如,裸鼹鼠可以活到41岁,比老鼠和其他类似体型的啮齿动物长10倍以上。
是什么导致了更长的寿命?根据罗切斯特大学(University of Rochester)生物学家最近的一项研究,这个谜题的关键部分在于控制基因表达的机制。
多丽丝·约翰·切里(Doris Johns Cherry)的生物学和医学教授Vera Gorbunova、该论文的第一作者Andrei Seluanov、Gorbunova实验室的博士后Jinlong Lu以及其他研究人员在最近发表在《细胞代谢》(Cell Metabolism)杂志上的一篇论文中研究了与寿命有关的基因。
他们的发现表明,控制基因表达的两种调节机制,即昼夜节律和多能网络,对长寿至关重要。这些发现对于理解长寿是如何产生的,以及为对抗衰老和与年龄相关的疾病提供新目标具有重要意义。
罗彻斯特大学的生物学家在比较26个不同寿命的物种的基因表达模式时发现,不同基因的特征受昼夜节律或多能网络的控制。
比较长寿基因 研究人员分析了26种哺乳动物的基因表达模式,这些动物的最长寿命从2年(鼩鼱)到41年(裸鼹鼠)不等。他们发现了数千个与长寿或正或负相关的基因,这些基因与物种的最长寿命有关。 他们发现,长寿的物种往往与能量代谢和炎症相关的基因表达较低;DNA修复、RNA运输和细胞骨架(或微管)组织相关基因的高表达。Gorbunova和Seluanov之前的研究表明,更有效的DNA修复和更弱的炎症反应是长寿哺乳动物的特征。 寿命较短的物种则相反,它们往往具有能量代谢和炎症相关基因的高表达和DNA修复、RNA运输和微管组织相关基因的低表达。 长寿的两大支柱 当研究人员分析调节这些基因表达的机制时,他们发现有两个主要系统在起作用。负寿命基因——与能量代谢和炎症有关——由昼夜节律网络控制。也就是说,它们的表达被限制在一天中的特定时间,这可能有助于限制长寿物种的整体基因表达。 这意味着我们至少可以在一定程度上控制负面寿命基因。 Gorbunova说:“为了活得更久,我们必须保持健康的睡眠时间表,避免晚上暴露在光线下,因为这可能会增加负寿命基因的表达。” 另一方面,积极的寿命基因——那些参与DNA修复、RNA运输和微管的基因——由所谓的多能性网络控制。多能性网络涉及到将体细胞(任何非生殖细胞)重新编程为胚胎细胞,胚胎细胞通过重新包装随着年龄增长而变得无序的DNA,更容易恢复活力和再生。 Gorbunova说:“我们发现,进化激活了多能性网络,从而延长了寿命。” 因此,多能性网络及其与积极寿命基因的关系是“理解长寿如何进化的一个重要发现,”Seluanov说。“此外,它可以为新的抗衰老干预措施铺平道路,激活关键的积极寿命基因。我们期望成功的抗衰老干预包括增加积极寿命基因的表达,减少消极寿命基因的表达。” 参考文献 Comparative transcriptomics reveals circadian and pluripotency networks as two pillars of longevity regulation
